Priešprasminių oligonukleotidų biotechnologija
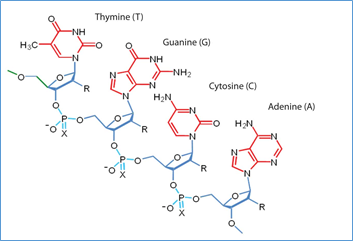 1 pav. Nukleorūgščių grandinė (oligonukleotido fragmentas)
1 pav. Nukleorūgščių grandinė (oligonukleotido fragmentas)
Priešprasminiai oligonukleotidai yra santykinai trumpos (įprastai 12-25 nukleotidų ilgio) vienos vijos nukleotidų grandinės, kurios yra komplementarios (priešprasminės) ląstelės prasminėms iRNR ar DNR sekoms.
Priešprasminiai oligonukleotidai prisijungdami prie iRNR užblokuoja jos transliaciją ląstelėje arba prisijungdami prie vienos iš DNR grandinių užblokuoja geno fragmento nuskaitymą. Tokiu būdu priešprasminiai oligonukleotidai slopina baltymo, koduojamo atitinkamos iRNR, sintezę, arba reguliuoja DNR transkripciją – genų raišką. DNR transkripciją slopina trigubą grandinę su DNR sudarantys oligonukleotidai, kurie hibridizuojasi su dvigrande DNR.
Pagal bendras nukleorūgščių bazių poravimosi taisykles oligonukleotidai gali būti universalia priemone genų raiškos reguliavimui tiek molekulinės biologijos tyrimų, tiek terapiniais, tiek bioinžinerijos ir net sintetinės biologijos tikslais. Remiantis žinoma iRNR ar DNR taikinio nukleotidų seka yra parenkamas ir susintetinamas tam tikrai jos daliai komplementarus oligonukleotidas. Oligonukleotido specifiškumą nulemia taikinio sekos unikalumas tarp visų ląstelės iRNR ar DNR sekų.
Statistiškai seka, sudaryta iš bent iš 17 nukleotidų pasitaiko tik 1 kartą visame žmogaus genome (4 × 109 bazinių porų). Dėl šios priežasties priešprasminių oligonukleotidų poveikis į iRNR ar DNR gali būti ypač specifinis.
Kadangi iRNR transliacijos ir DNR transkripcijos mechanizmai yra visos biologinės gyvybės pamatiniai mechanizmai, priešprasminių oligonukleotidų technologija yra ypač universali ir labai plačiai pritaikoma.
Panaudojant priešprasminių oligonukleotidų biotechnologiją galima reguliuoti iš esmės bet kokių prokariotinių ar eukariotinių ląstelių gyvybinius mechanizmus. Be to, sintetiniai modifikuoto karkaso priešprasminiai oligonukleotidai daugeliu atveju yra veiksmingesni bei stabilesni už natūralius ląstelinius mechanizmus.
Priešprasminių oligonukleotidų technologija yra labai universali, kadangi ji leidžia reguliuoti visų įmanomų genų raišką. Priešprasminių oligonukleotidų technologija yra kur kas paprastesnė už baltymų biotechnologijas. Priešprasminius oligonukleotidus sudaro tik keturios bazinės nukleorūgštys (A,C,T(U),G), tuo tarpu baltymus net 20 skirtingų amino rūgščių. Priešprasminiai oligonukleitidai yra santykinai mažos molekulinės masės ir nesudėtingos erdvinės struktūros, tuo tarpu baltymai gali būti ypač dideli ir sudėtingi. Maža molekulinė masė yra pranašumas dėl geresnės skverbties į ląsteles. Dėl šių priežasčių priešprasminių oligonukleotidų biotechnologija yra patraukli komerciniu požiūriu ir santykinai nebrangi.
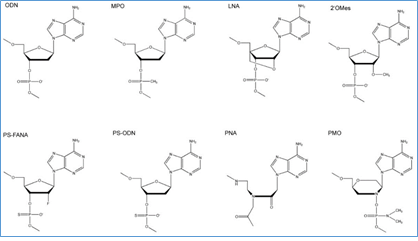
Pastaruoju metu sukurtos ir paplito sintetinio karkaso oligonukleotidų biotechnologijos, pagrįstos nukleotidų jungiamojo karkaso modifikacijomis, bazių modifikacijomis, angliavandenių modifikacijomis ar konjugatais įvairiose oligonukleotido vietose. Daugiausiai naudojamos ir geriausiai ištirtos yra fosfato karkaso modifikacijos, ypač panaudojant fosforotioatus, fosforoamidatus, metilfosfonatus, bei 3’ galo modifikacijos pašalinant arba blokuojant hidroksilo grupę. Pagrindinės priešprasminių oligonukleotidų modifikacijos yra pateikiamos 2 pav.
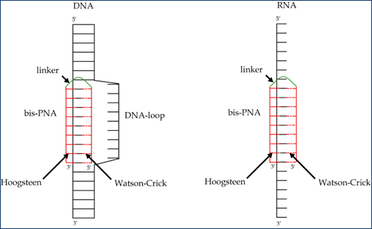
Dar labiau modifikuoti yra peptidinių nukleorūgščių arba morfolino nukleotidų polimerai. Juose nukleorūgšties karkasas, sudarytas iš fosfato ir angliavandenio liekanų, yra pakeistas atitinkamai peptidine grandine arba karbamatų sujungtų morfolinų grandine. Šios oligonukleotidų modifikacijos pasižymi ypač geromis hibridizacinėmis savybėmis ir atsparumu nukleazėms, todėl peptidinių nukleorūgščių priešprasminių oligonukleotidų (PNR) moksliniai tyrimai yra ypač pažangūs ir komerciškai perspektyvūs. Peptidinių nukleorūgščių priešprasminių oligonukleotidų savybės leidžia jiems ypač aktyviai hibridizuotis su DNR taikiniais (3 pav.), todėl peptidinių nukleorūgščių priešprasminiai oligonukleotidai yra labai perspektyvūs genų terapijos įrankiai.
Priešprasminiai oligonukleotidai prisijungdami prie iRNR užblokuoja jos transliaciją ląstelėje arba prisijungdami prie vienos iš DNR grandinių užblokuoja geno fragmento nuskaitymą. Tokiu būdu priešprasminiai oligonukleotidai slopina baltymo, koduojamo atitinkamos iRNR, sintezę, arba reguliuoja DNR transkripciją – genų raišką. DNR transkripciją slopina trigubą grandinę su DNR sudarantys oligonukleotidai, kurie hibridizuojasi su dvigrande DNR.
Pagal bendras nukleorūgščių bazių poravimosi taisykles oligonukleotidai gali būti universalia priemone genų raiškos reguliavimui tiek molekulinės biologijos tyrimų, tiek terapiniais, tiek bioinžinerijos ir net sintetinės biologijos tikslais. Remiantis žinoma iRNR ar DNR taikinio nukleotidų seka yra parenkamas ir susintetinamas tam tikrai jos daliai komplementarus oligonukleotidas. Oligonukleotido specifiškumą nulemia taikinio sekos unikalumas tarp visų ląstelės iRNR ar DNR sekų.
Statistiškai seka, sudaryta iš bent iš 17 nukleotidų pasitaiko tik 1 kartą visame žmogaus genome (4 × 109 bazinių porų). Dėl šios priežasties priešprasminių oligonukleotidų poveikis į iRNR ar DNR gali būti ypač specifinis.
Kadangi iRNR transliacijos ir DNR transkripcijos mechanizmai yra visos biologinės gyvybės pamatiniai mechanizmai, priešprasminių oligonukleotidų technologija yra ypač universali ir labai plačiai pritaikoma.
Panaudojant priešprasminių oligonukleotidų biotechnologiją galima reguliuoti iš esmės bet kokių prokariotinių ar eukariotinių ląstelių gyvybinius mechanizmus. Be to, sintetiniai modifikuoto karkaso priešprasminiai oligonukleotidai daugeliu atveju yra veiksmingesni bei stabilesni už natūralius ląstelinius mechanizmus.
Priešprasminių oligonukleotidų technologija yra labai universali, kadangi ji leidžia reguliuoti visų įmanomų genų raišką. Priešprasminių oligonukleotidų technologija yra kur kas paprastesnė už baltymų biotechnologijas. Priešprasminius oligonukleotidus sudaro tik keturios bazinės nukleorūgštys (A,C,T(U),G), tuo tarpu baltymus net 20 skirtingų amino rūgščių. Priešprasminiai oligonukleitidai yra santykinai mažos molekulinės masės ir nesudėtingos erdvinės struktūros, tuo tarpu baltymai gali būti ypač dideli ir sudėtingi. Maža molekulinė masė yra pranašumas dėl geresnės skverbties į ląsteles. Dėl šių priežasčių priešprasminių oligonukleotidų biotechnologija yra patraukli komerciniu požiūriu ir santykinai nebrangi.
Pastaruoju metu sukurtos ir paplito sintetinio karkaso oligonukleotidų biotechnologijos, pagrįstos nukleotidų jungiamojo karkaso modifikacijomis, bazių modifikacijomis, angliavandenių modifikacijomis ar konjugatais įvairiose oligonukleotido vietose. Daugiausiai naudojamos ir geriausiai ištirtos yra fosfato karkaso modifikacijos, ypač panaudojant fosforotioatus, fosforoamidatus, metilfosfonatus, bei 3’ galo modifikacijos pašalinant arba blokuojant hidroksilo grupę. Pagrindinės priešprasminių oligonukleotidų modifikacijos yra pateikiamos 2 pav.
Dar labiau modifikuoti yra peptidinių nukleorūgščių arba morfolino nukleotidų polimerai. Juose nukleorūgšties karkasas, sudarytas iš fosfato ir angliavandenio liekanų, yra pakeistas atitinkamai peptidine grandine arba karbamatų sujungtų morfolinų grandine. Šios oligonukleotidų modifikacijos pasižymi ypač geromis hibridizacinėmis savybėmis ir atsparumu nukleazėms, todėl peptidinių nukleorūgščių priešprasminių oligonukleotidų (PNR) moksliniai tyrimai yra ypač pažangūs ir komerciškai perspektyvūs. Peptidinių nukleorūgščių priešprasminių oligonukleotidų savybės leidžia jiems ypač aktyviai hibridizuotis su DNR taikiniais (3 pav.), todėl peptidinių nukleorūgščių priešprasminiai oligonukleotidai yra labai perspektyvūs genų terapijos įrankiai.